![]()
Az anyagi világ kémiai elemekből és ezek vegyületeiből áll. Az elemek atomos szerkezetűek. Minden elem atomjai felépítésükben egy-egy parányi naprendszerhez hasonlíthatók.
Az az elképzelés, hogy az anyag igen kis, tovább már nem osztható részecskékből áll, még az ókorból származik. Görög tudósok az anyag legkisebb részecskéinek atom nevet adták, ami oszthatatlant jelent.
A kémiai elemek molekulái egyforma kémiai jellegű atomokból, míg a vegyületek különböző kémiai jellegű atomokból állnak.
A 92 természetes kémiai elemnek 92 különböző atom felel meg. Az uránon túli elemek felfedezése számukat eddig 105-re emelte (neptúnium, plutónium, amerícium, kűrium, berkélium, kalifornium, einsteinium, fermium, mendelévium, nobélium, laurencium, kurcsatórium, hafnium).
Bohr elmélete szerint az összes kémiai elemek atomjai egy pozitív töltésű atommagból és e körül keringő meghatározott számú negatív töltésű elemi részecskéből, az ún. elektronokból áll.
A kémiai elemek atomjai csak annyiban különböznek egymástól, hogy atommagjaik tömege és töltése, valamint a körülötte keringő ún. kötött elektronok száma eltérő.
A legegyszerűbb atom a hidrogén. Atommagjának az összes atomok között a legkisebb a töltése és a tömege. Töltése egyezik az elektronéval, csak pozitív. A hidrogénatom magját Rutherford szerint protonnak nevezzük. Körülötte csak egy kötött elektron kering.
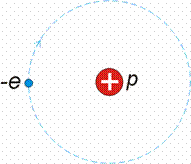
Hidrogén atom
A következő atom nagyság szerint a hélium. Magjának kétszer akkora töltése van és ennek megfelelően két keringő elektront tart fogva erőterének semlegesítésére.
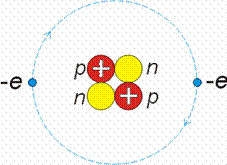
Hélium atom
Ily módon valamennyi kémiai elemet rendezhetjük. A 92. elem, az urán. Magjának 92 pozitív töltésegysége van, és 92 kötött elektron kering körülötte.
Mendelejev orosz és Lothar Meyer német tudós nevéhez fűződik az elemek periódusos rendszerbe foglalása. A rendezés alapja az atomok töltésszáma, az ún. rendszám vagy Z magtöltésszám.
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
|
|||||||||||||||||
|
H |
|
He |
|||||||||||||||
|
Li |
Be |
|
B |
C |
N |
O |
F |
Ne |
|||||||||
|
Na |
Mg |
|
Al |
Si |
P |
S |
Cl |
Ar |
|||||||||
|
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
|
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Xe |
|
Cs |
Ba |
La* |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Tl |
Pb |
Bi |
Po |
At |
Rn |
|
Fr |
Ra |
Ac** |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
110 |
111 |
112 |
|
|
|
|
|
|
|
|
|||||||||||||||||
|
Lantanidák* |
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
|
||
|
Aktinidák ** |
Th |
Pa |
U |
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr |
|
||
Mai periódusos rendszer
A kötött elektronok az atommag körül csak meghatározott pályákon, ún. energianívókon keringhetnek. Ezeket K, L, M, N, 0, P betűkkel jelölik. K az atommaghoz legközelebbi elektronpálya, L a következő stb. Minden energianívón csak meghatározott számú elektron keringhet. A K-pályán 2, az L-pályán 8, az M-en 18, az N-pályán 32 stb. Pauli szerint a kötött elektronok maximális száma 2×n2 az n-edik energianívón. Két energianívó között elektronok nem keringhetnek.
Amikor az atommag körül annyi elektron kering, ahány protont a mag tartalmaz, akkor elektromos egyensúlyban van. Így az 1-es rendszámú hidrogénnél a K-nívón (héjon is, szokás mondani) 1 elektron, a 2-es rendszámú héliumnál a K-nívón 2 elektron, a 3-as rendszámú lítiumnál a K-nívón 2 és az L-nívón 1 elektron kering stb. A 10-es rendszámú neonnál az L-nívó megtelik... A betelt külső energianívójú elemeket nemes gázoknak nevezik (hélium, neon, argon stb.).
A pozitív töltésű atommag elektromos erőtere - a nehézségi erőhöz hasonlóan - a távolsággal négyzetes arányban csökken. Ezért az atommag jóval erősebben köti a maghoz közelebbi pályákon keringő elektronokat (pl. a K-nívón), mint a távolabbiakat (pl. az M-nívón). A legkülsőbb pályán keringő elektronok kötése a leglazább. A kötési energia szempontjából számba kell venni azt is, hogy a nagyobb protontartalmú (rendszámú) magok nagyobb erővel vonzzák a belső elektronokat. Ezért pl. a héliumatom K-pályájáról könnyebb kiszakítani egy elektront, mint az uránatom K-pályájáról.Amikor az elektromos egyensúlyban levő atom külső erő hatására elveszíti egy vagy több kötött elektronját, vagy befogad külső betöltetlen pályájára egy vagy több elektront, akkor pozitív vagy negatív töltéstöbblete miatt elektromos erőtér veszi körül. Azt mondjuk, az atom ionizálódott, pozitív vagy negatív ion lett belőle.
Az atom egyszerű állapotváltozása a legkülső elektronhéjon történik. Egyszerű állapotváltozásnak számít az ionizáció, a kémiai kötések és a halmazállapot.
Az elemek egy részénél a legkülső, ún. vegyértékelektron vagy elektronok könnyen leválnak. Ilyenkor az atom kifelé pozitív (pozitív ion). Külső elektronjaikat könnyen veszítik el a fémek (kálium, nátrium, kalcium, réz, alumínium, vas, nikkel stb.) és a hidrogén. Elég oldatba tenni ezen elemek sóit és atomjaik már ionizálódnak.
Vannak elemek, amelyek könnyen befogadnak egy vagy több elektront. Ilyenkor az atom kífelé negatív (negatív ion). Ilyenek a klór, bróm, jód, kén, foszfor stb.
Amikor különböző elemek atomjai molekulákká egyesülnek, akkor vegyületek képződnek. Például a nátrium-klorid (NaCI) molekulában két atom azért kapcsolódik össze könnyen, mert a nátrium legkülső, könynyen leváló elektronját a klór könnyen befogadja. Igy a két különböző atomból két ion, mégpedig egy pozitív és egy negatív ion lett. Ezek vonzzák egymást és egymás mellett maradnak. Különböző elemek atomjainak molekulákká egyesülését heteropoláris kötésnek nevezzük.
Egyforma elemek atomjai is egyesülhetnek molekulákká. Például két nitrogénatom úgy alkot molekulát, hogy ha elég közel kerültek egymáshoz, úgy legkülső elektronjaik a két atommag körül közös pályán keringenek és így közös egységbe foglalják a két atommagot. Az ilyen molekulaképződést homopoláris kötésnek nevezzük.
Vannak elemek, amelyek elektronjaikat szorosan fogják és többletelektronokat sem fogadnak be, ezért molekulákat sem alkotnak és más elemekkel sem egyesülnek. Ilyenek a nemesgázok (hélium, argon, kripton, xenon, radon).
A molekulák szoros vagy laza kapcsolata egymással határozza meg az anyag halmazállapotát.
Szilárd halmazállapotú anyagok molekulái között olyan szoros az összeköttetés, hogy nem válnak el.
Folyadékok molekulái között számottevő kapcsolat nem alakul ki, egymás mellett akadálytalanul elmozdulnak, szétfolynak.
A légnemű anyagok molekulái távol vannak egymástól, csak a hőmozgás következtében ütköznek egymásba.
Az atomok és molekulák hőállapotuktól függően különböző sebességgel mozognak, egymással rugalmatlanul ütköznek. Ez a hőmozgás csak az abszolút nulla fokon (-273 °C) szűnne meg.
Az ütközések eredményeként az anyag a hőállapotának megfelelő térfogatra tágul, másrészt egy-egy molekula időnként kiszabadul, az anyag párolog.
A gázoknál a molekulák a sűrűségüktől függően hosszabb utat tehetnek meg ütközés nélkül, ezért nem párolognak, csak a hőmérséklet növelésekor jelentősebben tágulnak.
A gázt (esetleg folyadékot) alkotó, elektromos egyensúlyban levő atomok növekvő hőmérséklettel egyre sebesebben cikáznak és egyre veszélyesebbé válnak egymással összeütközéseik, míg végül megkezdődik az ionizálás, és egyre több atom veszíti el külső elektronját vagy elektronjait.
Egy atom ionizálásához az atomra jellemző (karakterisztikus), pontosan meghatározott értékű energia szükséges (ionizációs energia). Ezt az ionizációs energiát rugalmatlan ütközés esetében a részecskék mozgási energiája szolgáltatja. De ionizálódhat a gáz (vagy folyadék) valamilyen külső - például elektromágneses vagy korpuszkuláris - sugárzás hatására is. Az ionizálódás mindig fokozatosan megy végbe, így az elektromosan semleges állapotú gáztól a teljesen ionizált gázig, az ún. tökéletes plazmáig folytonos az átmenet, a fázisátalakulásokat (halmazállapot-változásokat) jellemző ugrásszerű változások nélkül. (Igazi fázisátalakulásokra jó példa a víznek két halmazállapot-változása: a fagyás és a párolgás. Mindkettőt jól meghatározott átalakulási hő jellemzi.) A gyakran hangoztatott nézettel ellentétben, a plazmaállapot nem tekinthető az anyag egyik különleges - negyediknek nevezett - halmazállapotának. A plazma ugyanis nem egyéb, mint többé-kevésbé ionizált, tehát elektromos tulajdonságokkal rendelkező gáz (esetleg folyadék). A plazmában az atomokról leszakított negatív töltéshordozók, az elektronok mintegy önálló életet kezdenek és hőmérsékletüktől függő sebességgel ide-oda száguldoznak a „megcsonkított" és így pozitív töltésűvé vált atomtörzsek, azaz pozitív ionok között. Benne a pozitív és negatív töltéshordozók mennyisége megegyezik.
Az elektromos töltések (elektronok és ionok) mozgása mindig mágneses tér keltésével jár. Az elektronok egyrészt az energianívókon keringenek az atommag körül (mint a bolygók a Nap körül), másrészt forognak a saját tengelyük körül. Az elektron a forgása során mágneses teret hoz létre, vagyis apró elemi mágnesként viselkedik, és így északi és déli pólusa is van, a forgástengelye pedig e két pólust összekötő egyenes. Az elektron a saját tengelye körüli forgását az elektron perdületével - vagy miként ezt a mikrorészecskék világában nevezik - a spínjével jellemezhetjük.
A perdület a szilárd testek, a spín az elemi részecskék mozgásállapotára jellemző fizikai mennyiség. Nagyságát és irányát a test, ill. részecske tömege és a saját tengelye körüli forgása határozza meg. A spín tehát vektormennyiség, amelynek - mint tudjuk - a nagyságán kívül iránya is van. A spín nagysága az azonos típusú elemi részecskék - pl. elektronok - esetében állandó, iránya azonban az atom rezgése során folytonosan változik.
Az elektronok - mint kis mágnesek - hatnak egymásra, és egy külső mágneses tér el is forgathatja őket ugyanúgy, mint az iránytű mutatóját a Föld mágneses tere.