![]()
Az atommagot elemi részecskék: protonok és neutronok alkotják. E részecskéket közös néven nukleonoknak nevezik.
Az atom mérete rendkívül kicsi, kb. 10 millió atomot kellene egymás mellé helyezni, hogy 1 mm hosszú láncot kapjunk.
Ha képzeletben egy ilyen atomot 5 m Æ -re növelnénk, akkor a közepében az atommag alig 1 mm Æ-jű volna.
A protonok és neutronok tömege elenyészően kicsi, de az elektronok tömege ezeknél is majdnem kétezerszer kisebb.
A proton és neutron tömege gyakorlatilag egyforma. Főleg abban különböznek, hogy a neutronnak nincsen töltése, vagyis elektromosan semleges, neutrális (innen származik elnevezése).
Az előbbiekből következik, hogy ha az atomok egymáshoz viszonyított tömegét akarjuk megállapítani, csak a protonok és neutronok tömegét kell összeadnunk, mert az elektronok tömege elhanyagolható.
Az atommagban található protonok és neutronok számának összegét, vagyis a nukleonok számát az atom
tömegszámának nevezzük és A-val jelöljük.
A periódusos rendszer elején levő elemeknél, a hidrogén kivételével, az atommag ugyanannyi neutront tartalmaz, mint ahány protont, tehát a tömegszáma a rendszám kétszerese. A 13-as rendszámú elemtől (az alumíniumtól) kezdve a neutronok száma növekedni kezd, és a rendszer végén levő uránban már több mint másfélszerese a protonok számának.
A kémiai elemeket nevük kezdőbetűjével vagy első két betűjével jelöljük (Hidrogén, Hélium, Bérilium, Szén, azaz Carbon, Nitrogén, Oxigén, Alumínium stb.).
Az
atomfizikában meg szokták adni az elemek Z rendszámát az elem jelétől
balra lent és A tömegszámát balra fent (![]()
![]() ,
, ![]() , …
, …![]() ,…).
,…).
E két adatból azonnal meg tudjuk állapítani az atommag összetételét, mert
a protonok száma = rendszám,
a neutronok száma = tömegszám-rendszám = A-Z.
Minden elemre szigorúan jellemző atommagjának protontartalma. Egyetlen proton elvétele vagy hozzáadása az atom kémiai sajátságainak megváltoztatását vonná maga után, vagyis más elemmé alakulna át. A neutronszámban bekövetkező változás legtöbbször csak az atom „tömegét" változtatja meg, kémiai tulajdonságait nem. Például, ha a 6 protont tartalmazó szénatomban a 6 neutron mellé egy hetediket is behelyeznénk, úgy 13-as tömegszámú szenet kapnánk. Ezt a szénatomot kémiai eljárásokkal nem lehet elválasztani a „normális" 12-es tömegszámú széntől, mivel ugyancsak 6-os a rendszáma.
Azokat az elemeket, amelyek csak neutronszámukban különböznek egymástól, azonos helyű elemeknek, görög szóval izotóp elemeknek nevezik.
A természetben minden elemnek több izotópja is előfordul. Mivel a természetben előforduló kémiai elemek atomjainak parányi része különböző izotóp, ezért az A tömegszámok többsége nem egész szám (pl. a hidrogén tömegszáma A=1,01, mert a természetben előforduló hidrogénatomok kb. 1%-a olyan izotóp, amelyeknél az atommag egy protonból és egy neutronból áll).
Az előbbiekből következik, hogy általában az anyag tömege, ill. súlya gyakorlatilag csak az atommagok tömegéből, ill. súlyából tevődik össze. Egy 70 kg-os emberben az összes elektronok alig tesznek ki 2 dekát. Gyakorlatilag 70 kg atommag van benne. Ismerve az atomok és az atommagok méreteit, megállapíthatjuk, hogy egy ember testének összes atommagjai (elektronok nélkül) alig gombostűfejnyi térfogatban elférnének. Ez a gombostűfej azonban 70 kg volna. Az ember testének többi térfogatrésze mind „hézag", a szó szoros értelmében vett vákuum.
Miután tudjuk, hogy az atommagok pozitív elektromos töltésű protonokból és semleges neutronokból épülnek fel, felmerül az a kérdés, hogy ezeket mi tartja össze?
Yukawa japán fizikus 1935-ben rámutatott, hogy egy ilyen összetett rendszert sem gravitációs erő, sem pedig az elektromágneses kölcsönhatás nem képes összetartani. Az elektromágneses erők határozottan a magot összetartó erők ellen dolgoznak, hiszen a csupa pozitív töltésű proton elektromosan taszítja egymást. Az atommagok mégis általában igen stabil képződmények, amit Yukawa az atommag részecskéi között levő nagyon rövid hatótávolságú, de rendkívül erős, eddig ismeretlen vonzóerő létezésével magyarázott. A tömegek között ható gravitációs, valamint az elektromos töltések között érvényesülő elektromágneses kölcsönhatáson kívül tehát van legalább még egy: az atommag részecskéit összetartó, ún. erős kölcsönhatás. Az ennek megfelelő erőket nevezzük magerőknek.
Yukawa szerint az atommagot a magerők és az elektromos taszítóerők révén együttesen kialakított „potenciálhegy" veszi körül, amelyből a mag részecskéi - általában - maguktól kijutni nem tudnak. A mag nukleonjai tehát egy potenciálvölgy mélyén fekszenek.
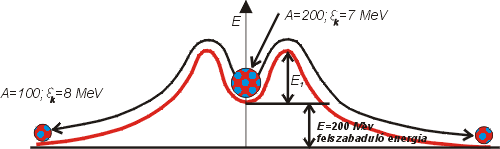
Az ábrán a függőleges tengelyen (E) a nukleonok helyzeti energiáját mérjük, a vízszintesen (r) a magtól való távolságukat.
A magot alkotó nukleonokat távolítsuk el egymástól gondolatban végtelen messze. Ekkor semmiféle erő nem hat közöttük, potenciális energiájuk tehát egymás erőterében nulla. Ezután közelítsük fokozatosan egymáshoz a nukleonokat. Az elektromos taszítás miatt, amely az azonos töltésű részecskék között hat, egyre nehezebb lesz egymáshoz közelíteni őket, potenciális energiájuk egyre nő (fölfelé mászunk a potenciálhegyre). Ha a részecskék kellően kis távolságra kerülnek egymáshoz, fokozatosan hatni kezdenek az elektromos taszításnál jóval erősebb magerők (erős kölcsönhatás), amelyek legyőzvén az elektromos erőket, egymáshoz vonzzák a nukleonokat (legurulás a potenciálvölgybe). Létrejön a kötés, kialakul az atommag.
Minél mélyebb a potenciálvölgy - tehát minél kisebb helyzeti energiájú állapotba jutnak a nukleonok -, annál nagyobb az egy nukleonra jutó ún. „kötési energia", amely a mag stabilitásának mértéke.
Vizsgáljuk meg, hogy a különféle kémiai elemek atommagjaiban hogyan változik az egy nukleonra jutó kötési energia?
Ábrázoljuk ennek érdekében a mag egy nukleonjának kötési energiáját (Ek)
a mag tömegszámának (A), vagyis annak függvényében, hogy hány nukleon
alkotja az illető elem atommagjait.
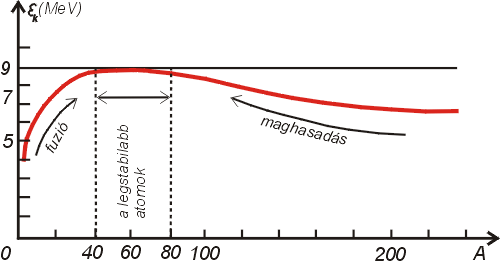
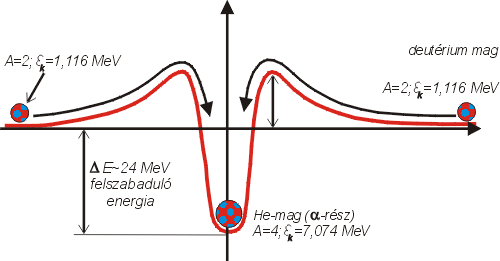
Az így kapott grafikon (4. ábra) érdekes, mert az atomenergia felszabadítása szempontjából igen értékes következtetésekre vezet. Leolvashatjuk a grafikonból, hogy a könnyű magokban (a kis tömegszámú elemekben, pl. hidrogén, hélium
stb.) az egy részecskére jutó kötési energia (Ek) a tömegszám (A) növekedésével elég gyorsan nő. Az A=50 és A=80 közötti magok esetén (vanádiumtól a kryptonig) a legnagyobbak a kötési energiák. Itt a görbe maximumot mutat; majd a nehezebb magok felé haladva tovább, fokozatosan csökkenést tapasztalunk.
A grafikonból következtethetünk arra, hogy ha valamilyen eljárással sikerül pl. hidrogén magjainak egyesítése hélium magokká (un. fúzió), vagy pl. urán magjainak széthasítása kisebb rendszámú elemekké (maghasadás), úgy mindkét esetben energia szabadul fel.